Vers le développement d’opioïdes sans effets secondaires pour lutter plus efficacement contre la douleur
Les opioïdes ont révolutionné le traitement de la douleur, mais ils présentent de graves effets secondaires pouvant conduire à l’arrêt de la fonction respiratoire et à la mort. Une consommation abusive de ces médicaments liée à leur caractère addictif est d’ailleurs associée à une épidémie de décès par overdose aux Etats-Unis et en Europe. Leur cible principale impliquée dans la réduction de la douleur et qui provoque les effets secondaires est le récepteur opioïde de type mu. Pour développer de nouvelles molécules analgésiques sans effets secondaires les scientifiques cherchent donc à comprendre comment les opioïdes agissent sur ce récepteur. Dans une nouvelle étude, des chercheurs et chercheuses de l’Inserm, du CNRS et de l’Université de Montpellier à l’Institut de génomique fonctionnelle ont identifié, au sein du récepteur mu, les rouages moléculaires à l’origine des voies de signalisation impliquées dans la réduction de la douleur. Ces résultats, publiés dans la revue Molecular Cell, ouvrent la voie au développement d’opioïdes dénués d’effets secondaires.
En 2019, les analgésiques opioïdes auraient été responsables de plus de 70 000 décès aux États-Unis, un lourd bilan, au point que l’on parle même d'une grave crise des opioïdes. En Europe et notamment en France, le phénomène suscite également des inquiétudes.
Les effets secondaires des médicaments sont souvent dus à des interactions involontaires avec de mauvaises cibles dans notre organisme. Aujourd’hui, les traitements médicamenteux dont nous disposons sont de plus en plus spécifiques à leurs cibles, grâce aux efforts considérables de la recherche pour réduire les effets secondaires. Toutefois, l'action des médicaments, même sur leur cible, peut encore produire des effets secondaires, parfois graves.
Ainsi, les médicaments opioïdes agissent sur nos récepteurs opioïdes, qui contrôlent non seulement la douleur, mais aussi la récompense, la dépendance, l'humeur et encore d'autres fonctions. S’ils réduisent la douleur, ces médicaments peuvent également produire une sensation d’euphorie ou de plaisir et devenir addictifs. En cas de consommation abusive, une surdose peut même conduire à un arrêt respiratoire et être fatale.
Afin de développer des médicaments plus sûrs, qui agiraient uniquement sur la douleur sans les effets secondaires, l’un des enjeux de la recherche est d’identifier la zone des récepteurs opioïdes impliquée spécifiquement dans le contrôle de la douleur, en quelque sorte le « bouton anti-douleur » des récepteurs. La nouvelle étude portée par l’équipe du directeur de recherche Inserm Sébastien Granier à l’Institut de génomique fonctionnelle (Inserm/CNRS/Université de Montpellier) apporte désormais des réponses à ce sujet.
Deux voix de signalisation principales au sein des récepteurs
Les récepteurs opioïdes sont des récepteurs couplés aux protéines G (on parle de récepteurs RCPG). Les humains possèdent 800 types de RCPG, qui contiennent les cibles d’environ 40 % des médicaments commercialisés. Cette famille de protéines partage une même architecture tridimensionnelle et deux principales voies de signalisation à l'intérieur des cellules.
Sous l'effet de stimuli (par exemple, un contact avec des médicaments), un RCPG comme les récepteurs opioïdes va adopter différentes conformations pour activer ou pour inhiber les voies de signalisation moléculaires de manière spécifique à l’intérieur des cellules, afin de déclencher différentes réponses et réactions biologiques.
En 2012, Sébastien Granier et ses collègues avaient déjà obtenu les premières structures 3D à haute résolution des récepteurs opioïdes. En 2015, son équipe était allée un peu plus loin, mettant au point une stratégie permettant d’observer les changements de conformations d’un récepteur opioïde particulier (le récepteur mu-opioïde), cible principale des analgésiques opioïdes, pendant sa réponse à ces médicaments. A présent, en comparant des opioïdes à d’autres molécules ayant peu d’effets secondaires, l'équipe vient de découvrir les rouages moléculaires qui seraient impliqués spécifiquement dans la réponse anti-douleur.
Pour parvenir à ces nouveaux résultats, les chercheurs ont combiné plusieurs méthodes innovantes en s’appuyant sur des simulations informatiques (en utilisant l’un des supercalculateurs les plus rapides de France, OCCIGEN), la spectroscopie RMN1 et des essais de pharmacologie sur cellules vivantes. Ils ont ainsi pu décrire dans les moindres détails la manière dont le récepteur mu-opioïdes répond aux analgésiques, pour identifier le « bouton » anti-douleur spécifique de ce récepteur.
- 1Connue également en imagerie médicale sous le nom d’IRM, cette technique exploite la propriété de certains atomes lorsqu’ils sont placés dans un champ magnétique pour obtenir des informations sur les mouvements fonctionnels ou changements de forme du récepteur lors de son activation
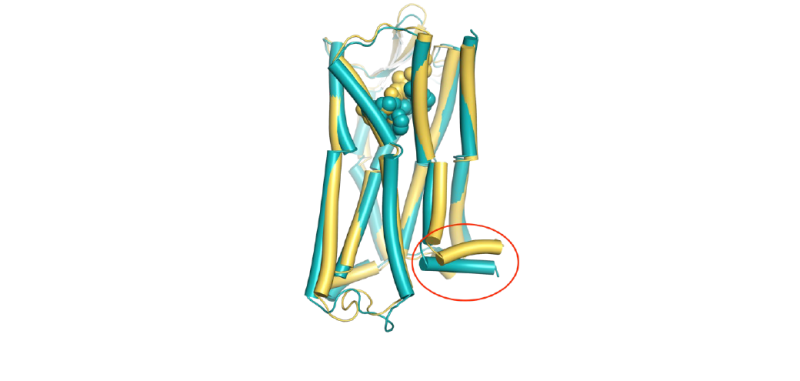
Deux modèles 3D du récepteur mu opioïde avec des analgésiques opioïdes. La substance médicamenteuse ayant peu d'effets secondaires (oliceridine, bleu) s'insère plus profondément dans la poche du récepteur qu'un opioïde classique (jaune), et ferme un espace dans le récepteur (en bas à droite) probablement à l'origine des effets secondaires.
Pour voir la modélisation 3D sous différents angles.
Améliorer les stratégies de développement des nouveaux médicaments
Les implications thérapeutiques de ces travaux sont potentiellement très importantes. « Mieux comprendre les mécanismes sous-jacents à l’inhibition ou à l’activation des voies de signalisation et identifier de manière plus précise l’endroit du récepteur sur lequel agissent les médicaments opioïdes est une grande avancée pour permettre à terme de développer des nouvelles molécules plus ciblées, activant seulement les voies qui nous intéressent, sans effets secondaires », souligne le chercheur Inserm Rémy Sounier, qui a co-dirigé cette étude.
Les scientifiques vont désormais poursuivre leurs recherches pour déterminer si les mécanismes identifiés sont universels pour d'autres récepteurs RCPG. Ils souhaitent également utiliser les nouvelles connaissances acquises pour développer de nouvelles molécules opioïdes qui pourraient avoir un intérêt thérapeutique avec des effets secondaires minimes.
Ce communiqué a été rédigé et diffusé par l'Inserm
Référence
Molecular insights into the biased signalling mechanism of the m-opioid receptor. Xiaojing Cong, Damien Maurel, Hélène Déméné, Ieva Vasiliauskaité-Brooks, Joanna Hagelberger, Fanny Peysson, Julie Saint-Paul, Jerome Golebiowski, Sébastien Granier, and Rémy Sounier. Molecular Cell, septembre 2021
DOI : https://doi.org/10.1016/j.molcel.2021.07.033
